PMDA 審査報告書の使い方について徹底解説!
どうも、はるきちです。
今日は、PMDAの審査報告書について書いてみたいと思いますが、皆さん『審査報告書』とは何かご存知でしょうか?
ご経験が豊富な方に対しては釈迦に説法だと思いますが、若手~中堅ぐらいのCRAさんの中には審査報告書を知らない人が弊社にも結構いますので、今日は審査報告書について書いてみたいと思います。
学生さんでこのブログをご覧になっている方も、開発の仕事のイメージを膨らせる意味を込めて、是非ご一読ください。
審査報告書とは何か?

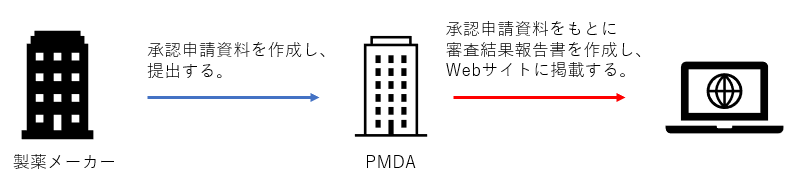
審査報告書は、PMDAが作成しWebサイトに掲載している資料です。
承認申請に関する資料は製薬メーカー(ICCCの場合はCRO)で作成し、PMDAに提出します。
PMDAでは、その資料をもとに審査結果報告書を作成します。
審査結果報告書は誰でも無料で閲覧することが可能です。
審査報告書の中身ですが、非臨床/臨床試験の結果が掲載されていますので、新たな試験が開始する時には類似薬や同じ適応で過去に承認を取得している薬剤の審査報告書を見るようにしています。
Oncology領域では、CRAとScientificな話をしたい先生が多いと思いますので、ご自身が担当している領域の既承認薬の勉強にはもってこいのツールです。
論文とは違い、日本語で書かれていますので、英語に対して抵抗がある人でもすんなり入っていけると思います。
あと、過去に自分自身が携わった薬剤で、既に承認されている薬があれば、それも併せて是非閲覧してみてください。
若手の方々にとっては、自分の頑張りが申請データにどのような形で落とし込まれるかがなかなかイメージできないと思いますが、審査結果報告書を熟読することにより、多少イメージが持てるようになるはずです。
実際に、MSD社のキイトルーダが、がん化学療法後に増悪した切除不能な進行・再発の子宮体癌の適応追加承認を取得した際の、審査報告書の表紙を以下に掲載しています。
表紙には審議結果として、承認の有無が記載されています。

具体的な閲覧手順

では、ここからは具体的な閲覧手順を説明いたします。
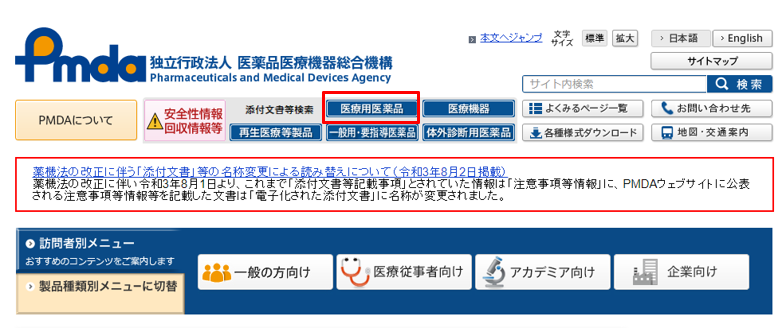
手順①:PMDAのWebサイトにアクセスする。
手順②:赤枠の『医療用医薬品』をクリックする。
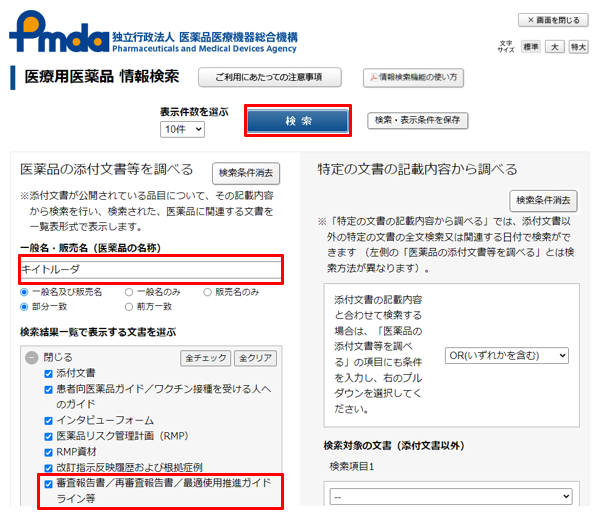
手順③:検索したい医薬品を入力し、検索ボタンを押す。その際、赤枠内の『審査報告書/再審査報告書/最適使用推進ガイドライン等』にチェックが入っていることを確認する。(デフォルトの状態ではチェックが入っていますので、特にチェックを変更する必要はありません。)
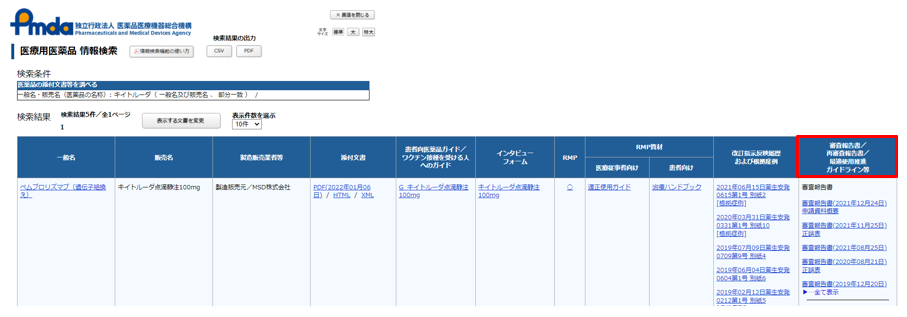
手順⓸:一番右の『審査報告書/再審査報告書/最適使用推進ガイドライン等』に掲載されている審査報告書をクリックする。適応毎に審査報告書が掲載されているため、閲覧したい審査報告書をクリックする。

審査報告書は本当に良い勉強の材料になりますし、その上無料で閲覧できます。是非、積極的に活用しましょう!
まとめ

常々ブログでも書いておりますが、臨床開発の世界では常に勉強がつきものです。
学ぶ意欲が無い人は時代に付いていけなくなりますので、ちょっとずつでも自分から学ぶ習慣をつけていきたいですね。
今日の学びが、1年後、3年後には大きな実りとなり、仕事への自信にも変わっていくはずです。
審査報告書に関して言えば、この内容を把握していてもCRAの仕事自体にはあまり影響が無いかもしれません。
ただし、この先違うRoleを目指している場合は、必ず目を通しておいた方が良いと思います。
特に、Clinical Scientistや薬事の方々は関連する領域の審査報告書には必ず目を通していますので、Clinical Scientistや薬事を目指している人は、早くからその習慣を身に着けておきましょう!
では!





















ディスカッション
コメント一覧
まだ、コメントがありません